肿瘤免疫治疗成功的关键之一在于CD8+ 细胞毒性T淋巴细胞的充分激活,然而在临床治疗过程中,肿瘤往往通过多种机制逃避CD8+ T细胞的识别和清除。T细胞维持正常免疫功能需要持续的能量供给, 而线粒体是细胞内氧化磷酸化和合成ATP的主要场所。在肿瘤微环境中,由于肿瘤细胞抢夺,造成O2、葡萄糖供应明显不足,T细胞线粒体会发生降解或收缩,致使T细胞“被饿死”,从而丧失其正常免疫功能。因此,在糖代谢受阻情况下,如何使CD8+ T细胞充分利用肿瘤微环境中的脂肪酸维持物质代谢,增强线粒体呼吸作用为细胞供能,是提高肿瘤免疫治疗效果的可行策略。
中国科学院沈阳应用生态研究所微生物资源与生态课题组徐明恺研究员,依托“沈阳市超级抗原研究重点实验室”,联合运用脂肪酸代谢质谱、海马生物能量代谢分析等方法,首次从分子到细胞水平揭示超级抗原SEC2及其改构体ST-4可通过激活mTOR/SREB/PPAR信号途径,增强CD8+ T细胞的脂肪酸合成和脂肪酸摄取能力;并通过激活p38-MAPK信号通路,增强线粒体能量代谢过程,从而为CD8+ T细胞供能,并维持其毒性T淋巴细胞的功能。该成果进一步丰富了超级抗原激活T细胞免疫应答的分子机制,也对超级抗原改构体作为免疫抗肿瘤生物新药的临床应用开发提供了新的理论依据。
该成果以“Staphylococcal Enterotoxin C2 Mutant-Directed Fatty Acid and Mitochondrial Energy Metabolic Programs Regulate CD8+ T Cell Activation” 为题,于2020年9月16日发表在美国免疫学学会(The American Association of Immunologists,AAI)旗下的免疫学Top期刊Journal of Immunology,论文第一作者为中科院沈阳应用生态研究所博士后付煊赫;通讯作者为中科院沈阳应用生态研究所徐明恺研究员。该项目得到了“中科院战略性先导科技A专项”、“辽宁省兴辽英才计划项目”、“沈阳市科技局中青年科技创新人才计划项目”、“沈阳市科技计划项目”的支持。
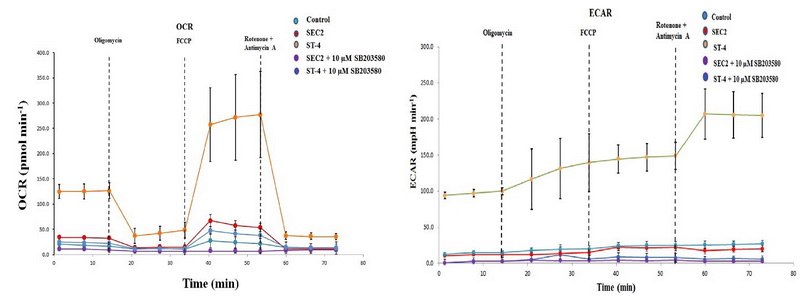
图1.超级抗原激活CD8+T细胞的海马生物能量代谢分析结果
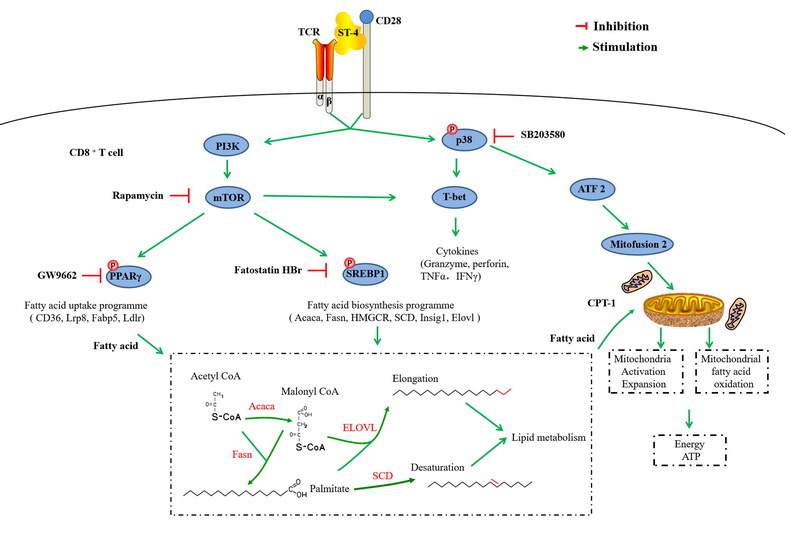
图2.超级抗原通过增强脂肪酸摄取和合成及提高线粒体能量代谢激活CD8+T细胞的信号通路