近日,中国科学院大连化学物理研究所生物分离分析新材料与技术研究组研究员叶明亮团队和吉林大学胡良海教授团队、我所分子模拟与设计研究组研究员李国辉团队合作,利用蛋白质结合药物以后对变性引起的沉淀具有更高的耐受性原理,发展了一种新型的药物靶标蛋白质鉴定方法。
靶标蛋白的发现对药物作用机制的研究和药物的重新定位提供理论指导。传统的基于活性探针和亲和色谱的靶标鉴定方法,都需要对小分子或药物进行共价修饰,经常会改变药物的特异性和亲和力,从而导致药物蛋白靶标的假阳性鉴定。因此,需要发展一种无需对药物进行任何化学修饰,且不依赖亲和力大小的药物靶标蛋白质鉴定方法。
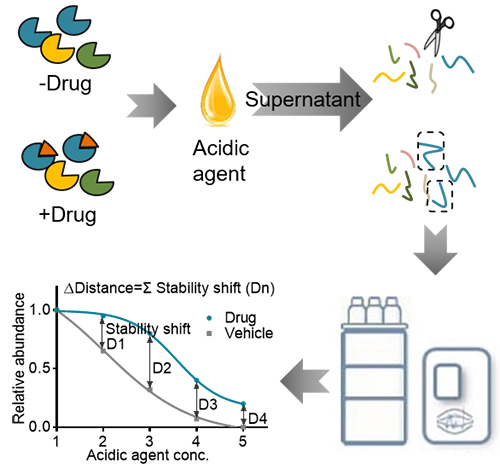
大连化物所发展高效药物靶标鉴定新方法
本工作中,合作团队利用药物结合蛋白比未结合蛋白具有更高的稳定性,因此对酸性试剂引起的蛋白变性沉淀具有更高的耐受性的原理,发展了一种非修饰药物靶标蛋白质组学鉴定新方法——pH依赖蛋白沉淀法(pH-dependent protein precipitation, pHDPP)。科研人员利用该方法筛选到了叶酸衍生物、ATP类似物、细胞周期蛋白抑制剂和免疫抑制剂的已知靶标蛋白,验证了该方法的可行性和稳健性;利用广谱激酶抑制剂作为模型药物,验证了该方法的高灵敏度和与热变性等其他方法的互补性;应用该方法筛选了45个双氢青蒿素的潜在靶标蛋白,主要参与代谢和凋亡途径。此外,科研人员通过结构对接和基于AI的靶向预测方法,验证两个与癌症相关的候选靶标蛋白ALDH7A1和HMGB1,进一步利用细胞热偏移方法确定了他们之间具有较强的亲和力。pHDPP具有特异性高、通量高、成本低、操作简单等优势,解决了传统基于药物修饰的化学蛋白质组学方法需要对配体修饰的难题。pHDPP可构建靶标蛋白空间,对于揭示药物作用机理具有重要意义。
近年来,叶明亮团队在基于非修饰药物靶标蛋白质组学鉴定方面发展了一系列方法(Analytical Chemistry,2020;Analytical Chemistry,2020;ACS Chemical Biology,2022),并应用于中药紫草素(Signal Transduction and Targeted Therapy,2022)、持久性污染物全氟辛磺酸(Analytical Chemistry,2022)和肝毒性化合物格尔德霉素(Analytical Chemistry,2020)靶标蛋白的鉴定中,促进了相关药物药理及毒副作用机理的揭示。团队发展的方法为药物或小分子靶标蛋白的筛选提供了平台。
相关研究成果以“Highly effective identification of drug targets at proteome level by pH-dependent protein precipitation”为题,发表在《化学科学》(Chemical Science)上。上述工作得到了国家重点研发计划、国家自然科学基金、大连化物所创新基金等项目的支持。