说到科学界的“跨界”奇才,大家会想到精通物理学、数学、经济学的牛顿,写出相对论的专利局职员爱因斯坦。不过,如果领域内几个学术大佬跨界合作,会搞出什么事情?
近期,在著名的学术期刊PNAS《美国科学院院刊》上发表了来自加州大学伯克利分校科学家们的一项成果,他们开发了一种能够高效地向哺乳细胞内传递生物大分子的电转(电穿孔)平台。

文章发表在著名学术期刊PNAS
这项成果除过在技术上取得的进步值得关注之外,进展背后的故事更为精彩!
啥是电转?和我们有啥关系?
电转,是一种应用于多种类型细胞,通过对细胞表面施加瞬时高强度电压,使细胞膜表面形成纳米孔,通透性提高,从而可以使生物大分子进入细胞的技术。电转的具体过程、所需要的装置及耗材如下。
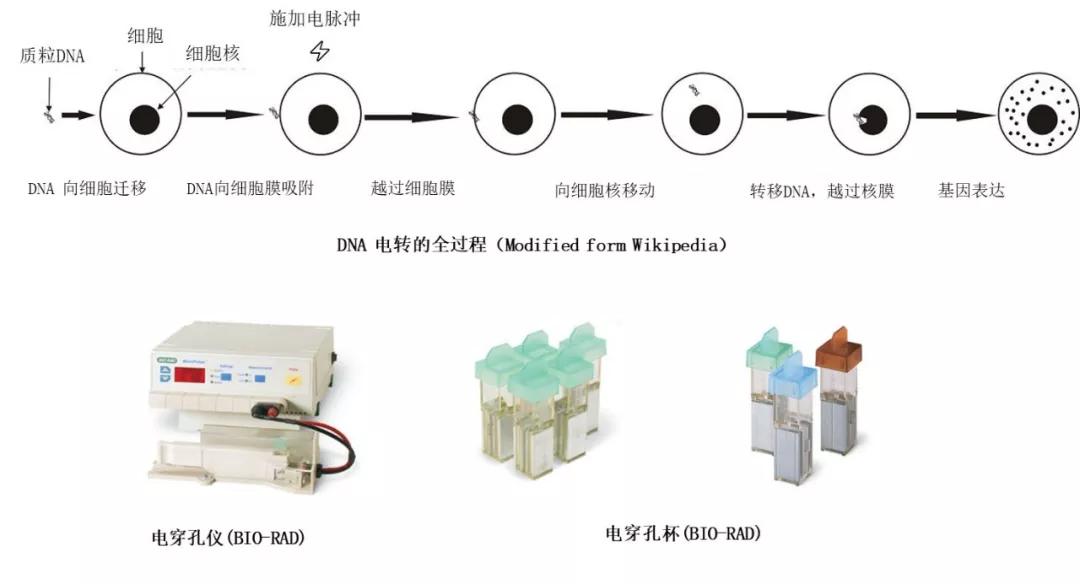
但是,对于一个时刻正常运转的生命机体,科学家们为什么要突破重重技术难关,外加电压干预其细胞膜的通透性?他们想尝试传递的生物大分子有什么作用呢?
事实上,科学家一方面是希望理解生命系统运行的规律,另一方面希望能够利用规律去针对性地改造生命体。而对生命体的改造直接依赖于像DNA和蛋白质这一类生物大分子,电转作为一种能够高效地向细胞内传递这些生物大分子的技术,它对我们理解生命活动规律地重要性不言而喻。
研究中的生物大分子包括了核酸,功能性的蛋白,Cas9和单链引导RNA所组成的核糖核蛋白。这些大分子都是目前炙手可热的基于CRISPR系统的基因编辑技术所需要的组分,只有将这些生物大分子所能实现的功能和这个高效的传递装置联系起来,才能对它所带来的便捷性有更清晰地了解。
当材料学撞上生物学
常规的电转方法虽然可以作为一种普适的方法将生物大分子比如蛋白质、DNA传递到不同种类的细胞内,但是存在一些缺陷。比如在向电转杯两侧的金属电极通电形成瞬时高电压时,电转杯内细胞细胞膜所有的部分均要承受所形成的高强度电场,因此很多细胞会因为细胞膜表面形成的孔洞太大而死亡,直接导致了回收的细胞数目相对较少。
细胞的回收率低是生物学家遇到的问题,从装置开发的角度上解决这个问题的方向是两个,分别是在保证转化效率的前体条件下降低外加电压的强度以及缩小细胞膜上承受电场的面积,但从这个角度去解决问题可不是生物学家的特长。
当一个生物学家遇到自己不擅长的问题时,一个明智的做法是将其分享给能解决这个问题的人,然后合作。
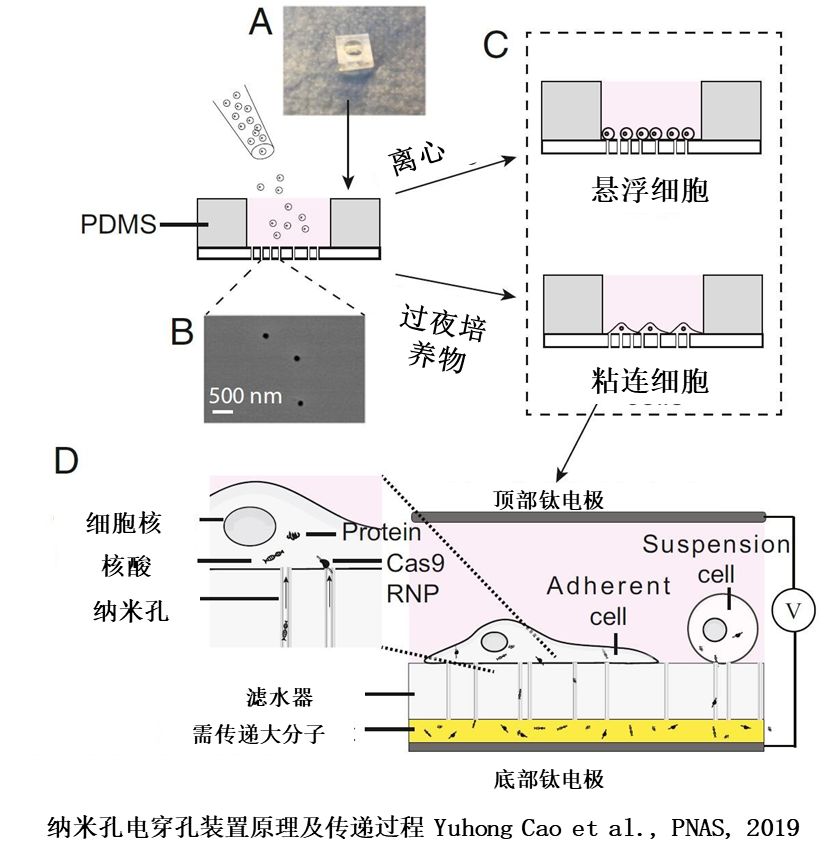
文章所开发的纳米孔电穿孔装置,主要由两个扁平的电极,一个带有过滤功能并且散布有直径大约为100nm纳米孔的碳酸脂膜(PC膜)以及一个用来支撑两个电极的支撑部分组成,需要注意的是膜上有能够促进细胞和膜接触的涂层。
在使用新装置进行生物大分子的转化时,首先将需要传递的试剂加到底部的钛电极上,之后立即将带有膜的支撑部分放置到底部电极之上,接着第二片钛电极被放到整个装置的顶部,最后给两个电极之间施加电脉冲,使细胞膜上形成纳米孔,生物大分子得以进入细胞内部。
那么这个新装置是如何突破传统电穿孔仪的缺陷呢?
首先是细胞承受电场面积过大的问题。新装置里带有纳米孔的PC膜,多孔PC膜可以使得电场和细胞的接触面限于纳米孔,这样大大的保证了接受电脉冲后细胞的完整性,因而可以使得在实验条件下用新装置做完转化后95%的细胞是可以继续生长的。
其次是传统的电穿孔仪在施加电脉冲时所用的电压往往为数千伏特,会使得细胞膜表面形成的孔洞过大。新的装置绕过这一问题得益于孔状的膜结构增强了纳米孔内和周围的局域电场,使得在外加电压不超过100V的条件下就可以高效的将DNA或者mRNA转化进细胞内。在这项研究中,这种高效对应的数字是80%。
当材料学与生物学相遇,碰撞出的火花让电转的研究向前迈进一大步。
“神仙打架,凡人勿近”
这篇文章作者排名最后两位分别是Jennifer A. Doudna和Peidong Yang(杨培东),分别是这参与这项研究的两个主要团队的负责人,笔者看到这篇文章的时候一是对两位前辈良好的合作意识表示钦佩,惊叹于新平台设计精巧之余,对二者的合作也是有些感慨。

这两位在各自的研究领域都是非常出色的科学家,同样都属于加州大学伯克利分校,杨培东教授曾在2011年汤森路透遴选的最优秀的化学家榜单中排第10位,同时入选了10年中最优秀的100名材料学家中的第一位,他主要的研究方向之一是人工光合系统。Jennifer教授则在2012年和Emmanuelle Charpentier教授共同提出了将CRISPR系统应用于基因编辑的想法并验证了其可行性,而基于CRISPR的基因编辑技术目前已经在基因编辑领域掀起了一场革命。
杨培东教授曾在2016年发表了一篇“为细菌装半导体”的文章,创造性的将一种半导体材料和一种非光合固碳微生物结合在一起,构建成了一个能够利用光能进行CO2固定的人工光合系统,算是这个领域的开山之作。文章最后展望了借助合成生物学工具对他们所构建的人工光合系统性能进行提升的未来前景,鉴于伯克利分校的合成生物学研究所有很多卓越的合成生物学家,他当时的展望可以被视为今日合作的一个伏笔。
机遇从“天”而降
Jennifer进入CRISPR的研究领域之前就已经是一位卓越的生物化学家,早在2002年她就已经当选了美国科学院的院士。作为生化学家的Jennifer是如何接触到CRISPER的研究并取得巨大成就的呢?
时间回溯到2006年,彼时的Jennifer还没涉足CRISPR研究。她接到一个同样来自伯克利分校的地球微生物学家Jillian的电话,这个电话对于Jennifer的CRISPR生涯是一个很重要的节点。
原来,Jillian实验室的主要研究微生物和环境的关系,她想在伯克利分校找一个研究RNA干扰的实验室进行合作。在经过Google简单的搜索之后找到了Jennifer,但两人并不熟,Jennifer也只是对Jillian的名声有所耳闻,因为Jillian在当年刚当选美国科学院院士。

Jillian的研究本身交叉性就比较强,这一点从她在多个学院担任教授职位就能可见一斑,所以当这位地球微生物学家激情洋溢地介绍自己的工作,说她们发现了一些CRISPR系统,并希望能够借助遗传学和生化的手段去了解这些系统,尽管对CRISPR不了解,Jennifer还是受其感染,好奇心也被激发起来,答应了之后的面谈。
2006年,Jennifer刚从耶鲁到伯克利不久,也希望能够进一步拓宽自己的研究领域,并且希望能够和伯克利的同事有一些合作。在这样的背景下,两人所擅长的领域不同,优势能够互补,而且都有合作的意愿,这样见面后的合作基本是水到渠成的。
最终,两人合作从未培养的细菌里发现了两种之前未被报道的CRISPR系统—CRISPR/CasX和CRISPR/CasY,这两个系统是截至当时所发现的最小的CRISPR系统,后续CRISPR/CasX系统也被证明可以改造成一种新的基因编辑工具,而这两项工作最终均在2016年和2019年发表在Nature上。
Jennifer事业的第二春
Jennifer教授接触到令她功成名就的II型CRISPR系统CRISPR/Cas 9得益于在一次2011年美国微生物年会上与Emmanuelle的相遇以及交流。彼时Emmanuelle所领导的研究组刚刚在Nature上报道了新的、也就是我们现在所熟悉的II型CRISPR/Cas9系统。

两人会前并不认识,但是对彼此的工作有一些了解。经两位共同的朋友引荐,两人在会议间隙的一个咖啡馆碰面,在简短的交流中对彼此都留下了很不错的印象。Emmanuelle希望能够借助Jennifer实验室在生化和结构生物学方向的优势来合作一起揭示新系统的工作机制,Jennifer当然没有错过这个难能可贵的机会。隔年,她们合作的文章《A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity》发表在了Science上,再之后,基于CRISPR的基因编辑工具在基因编辑领域便掀起了一场革命。
跨界之前的准备:打铁还需自身“硬”
最后,想要分享的是这几位科学家之间合作带给笔者的启示。从一个科研人员的角度讲,在自己所从事的领域工作得做的足够出色、有显示度,这些是和非本专业研究人员建立合作的基础,否则你不会知道你错过的究竟是未来可能的诺贝尔奖还是巨额的收益,这个道理最起码从Jennifer的身上来讲是这样。
另外,广泛涉猎不同领域的知识对于扩宽自己研究的广度和深度也是一个很重要的因素。文中提到的四位科学家涉猎的广泛,从其中的三位至少在两个不同的学院担任教授职务便可见一般。
最后,当“天降大任于斯人”的合作机会摆在眼前时,记得好好把握,说不定就顺顺溜溜地走上人生的巅峰!
参考文献:
(文章来源:中国科学院青岛生物能源与过程研究所)